研究胎盘发育机制对深入探究人类孕早期特征和女性生殖健康意义重大。科学家通过构建“迷你胎盘”(滋养层细胞类器官)揭示出胎盘发育过程及其与子宫内膜的相互作用。相关研究成果刊发在《Cell Stem Cell》(影响因子IF=23.90)上。这项最新成果推开了研究人类早期妊娠的大门,促进更好地理解先兆子痫等妊娠疾病,提供预防及治疗的新机遇。
胎盘(placenta)介于胎儿与母体之间,是维持胎儿生长发育的重要器官。在整个妊娠期间支撑胎儿,提供气体交换、营养物质和血液供给等,胎盘发育异常则是造成母体/胎儿死亡的主要原因。
而通过人类孕早期阶段研究胎盘发育机制的实验颇具挑战性,很难从正常或异常胎盘中寻求胎盘与子宫内膜相互作用过程的详细机制。幸运的是,伴随着再生医学的发展,“类器官”逐渐成为体外研究的绝佳场所,这为人类胎盘研究提供了新思路和新工具。
近日,剑桥大学的科学家Ashley Moffett与Friedrich Miescher Institute(弗里德里希·米歇尔生物医学研究所)的研究人员合作,在《Cell Stem Cell》发表研究论文[1],指出通过构建“迷你胎盘”(滋养层细胞类器官)揭示出胎盘发育过程及其与子宫内膜的相互作用。该研究还通过单细胞RNA 测序(scRNA-seq)技术,确定了一组人类子宫自然杀伤细胞(uNK Cells)产生细胞因子。这些发现将有助于科研人员更好地理解妊娠期间胎盘的发育情况,并可能在未来治疗先兆子痫等妊娠期疾病。

△ 科学家们在实验室培养出“迷你胎盘”,并利用它们来揭示妊娠早期阶段胎盘发育情况。
01
突破研究模型桎梏
“迷你胎盘”助力妊娠期疾病研究
胎盘早期发育,是关乎妊娠能否成功的关键,对研究人员而言,这也是一个极具挑战的高难度实验。
胎盘植入子宫内膜,通常被描述为“人类发展的黑匣子”。
本研究作者之一,来自剑桥大学病理学系Ashley Moffett教授指出,大多数主要的妊娠疾病(如先兆子痫、死胎、生长受限等)都取决于胎盘在最初几周的发育情况。在此期间,子宫内膜细胞和胎盘细胞之间的相互作用(尤其是增加母体对胎盘的血液供应),决定了胎儿的生长发育,影响着妊娠是否成功。
先兆子痫(子痫前期,preeclampsia)是一种妊娠期特有的、具有较大危害的多系统进展性疾病。该病有可能导致胎儿宫内发育迟缓,甚至胎盘早剥、胎死宫内,还可能导致新生儿窒息;对孕妇而言,可能会出现脑出血、脑梗,视力低下,严重者甚至失明。
先兆子痫发病率约为4—6%,尤其在初产妇中,发病率更是高达1.5-2倍。严重威胁着胎儿和孕妇的的生命健康,一旦发现,需要及时就诊和治疗。
在过往的研究中,科学家们对胎盘和子宫之间的相互作用了解甚少,一定程度上限制了对人类胚胎深入研究。
而这项创新实验中,研究团队利用“滋养层细胞”培育出“迷你胎盘”,与早期胎盘非常接近。成功揭开了孕早期阶段研究的“迷思”,进一步提升了对女性生殖健康的理解。
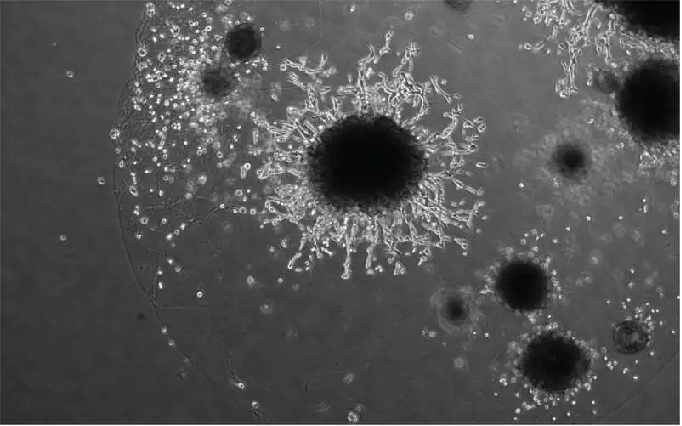
△ 胎盘类器官(中间的圆圈)。滋养层细胞从类器官中侵入,类似于妊娠早期侵入子宫的胎盘细胞。图片来源:Friedrich Miescher Institute/University of Cambridge
在此前的研究中,该团队已经发现增加先兆子痫等疾病风险的基因或保护基因。这些研究强调了在子宫内独特的免疫细胞的重要作用,这些细胞被称为“子宫自然杀伤细胞"(uNK Cells)”,它们聚集在子宫内膜的胎盘植入部位,这些细胞介导子宫内膜和胎盘细胞之间的相互作用。
动物模型研究表明,uNK细胞影响动脉重塑和滋养层侵袭。而在最新研究中,科学家将 uNK 细胞分泌的蛋白质应用于滋养层类器官,以便这些类器官能够模拟胎盘植入的条件。
该研究确定了对于滋养层类器官发育至关重要的细胞因子。这些细胞因子将有助于成功植入,使胎盘植入子宫并转化母亲的动脉。
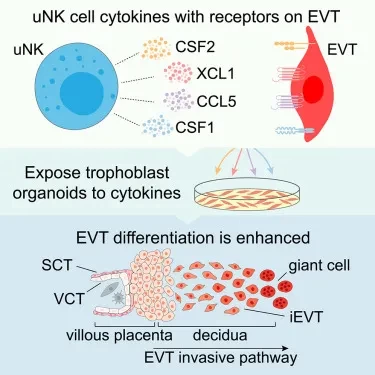
△ 研究人员通过“迷你胎盘”类器官模型发现一组uNK细胞产生的细胞因子——XCL1、CSF2、CSF1和CCL5,表明了uNK细胞和滋养层之间最佳免疫相互作用如何提高繁殖成功的机制。
“这是我们知道的唯一一次正常细胞侵入并转化动脉的情况,并且这些细胞来自另一个个体——婴儿。”Moffett教授表示,如果这些细胞不能正常植入,子宫动脉就无法打开,胎盘和婴儿就会缺少营养和氧气,导致怀孕后期出现问题,胎儿缺乏足够的血液供应,从而发育停滞甚至死亡。
研究人员还发现了几个调节血流和帮助植入的基因,Moffett教授说,这为未来更好地研究先兆子痫等妊娠疾病奠定了理论基础。
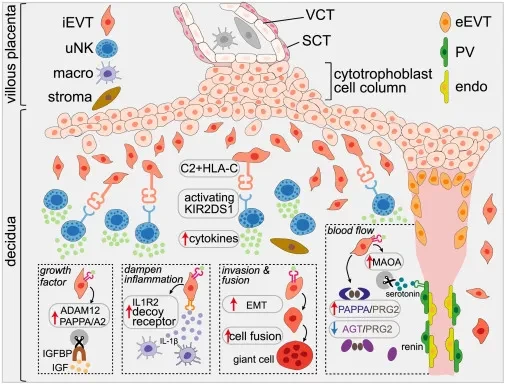
△ 显示妊娠早期胎盘中关键细胞类型的图表,显示了母体 uNK 细胞和胎儿 EVT (绒毛外滋养细胞)之间的相互作用。
综上,这个被称为“滋养层细胞类器官”的迷你胎盘,为研究人类早期妊娠推开了新世界的大门,帮助我们更好地理解细胞介导子宫内膜和胎盘细胞之间的相互作用。有望为更好地理解先兆子痫等妊娠疾病提供科学依据,提升对女性生殖健康的理解,促进人类早期胚胎阶段研究的不断深入。
02
类器官立大功
为女性生殖健康开辟新策略
从iPSC技术到干细胞衍生类器官,人类逐渐突破过往的研究瓶颈,试图寻求更高维度认知疾病,治愈疾病的可行策略。
“类器官”研究平台在很大程度上可以模拟目标组织或器官的遗传特征和表观特征,被认为在器官发育、精准医疗、再生医学、药物筛选、基因编辑、疾病建模等领域都有广泛的应用前景。
得益于类器官技术的发展,已经有卵巢、子宫颈、子宫内膜等类器官模型的出现,这些技术突破为深入研究女性生殖健康相关疾病更添研究良策。
卵巢类器官
卵巢对于女性的重要意义不亚于子宫,学术界对于卵巢的相关研究,一直苦于缺乏基础研究模型而举步维艰。
2023年,由美国哈佛大学的科学家联合杜克大学,创造出第一个全人源卵巢类器官,成功复制了人类卵巢器官的许多关键功能,可以支持卵细胞成熟、发育卵泡并分泌性激素。
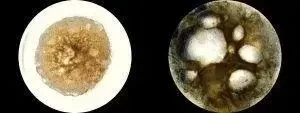
△ 人卵巢类器官中发育6天(左)和26天(右)的卵泡样结构
值得关注的是,这项新方法[2]整个培养过程仅仅花了5天时间!这标志着人类在女性生殖健康研究领域迈出了重要一步,为开发治疗不孕症、卵巢癌等疾病带来新疗法。
宫颈类器官
提到子宫颈就不得不说人尽皆知的HPV(人类乳头瘤病毒),作为宫颈癌的最大威胁,具有重要的研究意义。
为了克服目前缺乏合适的上皮原代细胞模型来概括人类宫颈外分层上皮和模型疾病的发展,Nature子刊的研究[3]指出,从健康供体中分离出的宫颈癌干细胞被嵌入Matrigel(基质胶)中以培养3D类器官。通过在患者的外子宫颈类器官中建立衣原体和HPV共同感染模型,可揭示不同的细胞重编程。
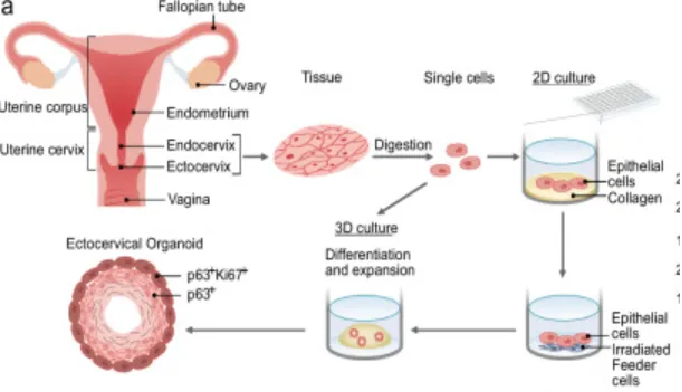
△ 活检生成宫颈类器官和干细胞培养物的示意图
借助这个体外模型,科学家研究了宫颈生物学的各个方面,包括细菌、病毒感染和合并感染的影响及其分子机制,为治疗宫颈癌等女性常见癌症,提供了新的研究模型和借鉴思路。
子宫内膜微环境类器官
子宫,是孕育生命、分泌激素、维持正常月经的重要场所。
然而子宫内膜的异常会引发(诸如月经不调、痛经、异常子宫出血、子宫内膜炎、子宫腺肌病、不孕症等)女性生殖系统疾病。传统的2D成像在一定程度上限制了科学家对子宫内膜形状及子宫微环境的复杂性的评估,制约了相关疾病的深入研究。
麻省理工学院(MIT)的科学家们发现,通过建立新的合成细胞外基质,可以设计出一种3D子宫内膜微环境,同时研究子宫内膜上皮类器官和基质细胞。这个类器官共培养模型不仅支持长期(15天)培养,而且可以模拟人类月经周期的关键方面。[4]
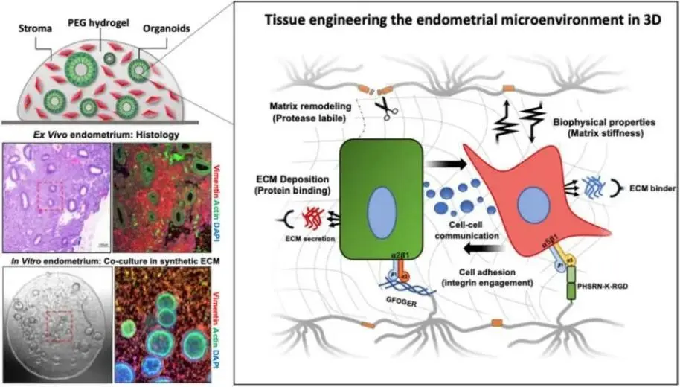
△ 人体3D子宫内膜微环境的研究模型图
子宫内膜类器官的诞生,将促进对女性月经、生殖健康和子宫内膜相关相关疾病(子宫腺肌病、子宫内膜异位症、子宫内膜癌等)致病机制的深入理解。
随着再生医学的日新月异,那些严重威胁女性健康的复杂疾病(如卵巢癌、子宫颈癌、子宫内膜癌、不孕症等),有望通过类器官技术,提供绝佳的体外实验场所,为深入疾病机制学术研究,贡献疾病预防、个性化治疗等贡献更多可能性,推进人类健康迈进更光明的未来。
Write in the last
写在最后
类器官开启了再生医学的新篇章。通过建立有价值的疾病模型,在体外模拟重现病人疾病模型,为研究复杂疾病提供了科学依据和实验场所。不仅如此,类器官的培养,对肿瘤治疗来说,也有极强的优势,可以用作药敏检测、药物筛查、个性化治疗的高效途径。可以预见的是,类器官技术正以乘风破浪之势,昭示未来医学发展光明的前景。
参考文献(可上下滑动)
[1] Qian Li,Andrew Sharkey,Megan Sheridan,Ashley Moffett,et,al.Human uterine natural killer cells regulate differentiation of extravillous trophoblast early in pregnancy,January17, 202,Cell Stem Cell,DOI:https://doi.org/10.1016/j.stem.2023.12.013
[2] Merrick D Pierson Smela, Christian C Kramme,et,al.Directed differentiation of human iPSCs to functional ovarian granulosa-like cells via transcription factor overexpression.Feb 21, 2023 https://doi.org/10.7554/eLife.83291
[3] Nur Yucer,et al,Human iPSC-derived fallopian tube organoids with BRCA1 mutation recapitulate early-stage carcinogenesis,Cell Reports(2021).DOI:https://doi.org/10.1016/j.celrep.2021.110146
[4] Juan S. Gnecco ,Alexander Brown,et al ,Organoid co-culture model of the human endometrium in a fully synthetic extracellular matrix enables the study of epithelial-stromal crosstalk,Med(2023).DOI:https://doi.org/10.1016/j.medj.2023.07.004
未经数字化报网授权,严禁转载或镜像,违者必究。
特别提醒:如内容、图片、视频出现侵权问题,请发送邮箱:tousu_ts@sina.com。
风险提示:数字化报网呈现的所有信息仅作为学习分享,不构成投资建议,一切投资操作信息不能作为投资依据。本网站所报道的文章资料、图片、数据等信息来源于互联网,仅供参考使用,相关侵权责任由信息来源第三方承担。
Copyright © 2013-2023 数字化报(数字化报商业报告)
数字化报并非新闻媒体,不提供新闻信息服务,提供商业信息服务
浙ICP备2023000407号数字化报网(杭州)信息科技有限公司 版权所有










